Nouveaux Traitements (articles publiés de 2005 à 2012)
AKT, cette protéine-enzyme qui favorise la survie des cellules cancéreuses dans certains cas de lymphomes parmi les plus répandus (15 000 cas de lymphomes annuels en France), trouble le diagnostic des médecins et pourrait causer une part non négligeable des rechutes de ces tumeurs du système immunitaire. Si les progrès de la médecine ont permis une guérison chez 60 % des patients, ce qui est un progrès notable, cette protéine pourrait être responsable de rechutes avec un taux de survie à deux ans de seulement 25 %. Dans les jours qui viennent, le Centre Léon Bérard à Lyon, un des vingt centres de lutte contre le cancer, débute avec d'autres centres en France un essai clinique sur 51 patients à partir d'une molécule d'origine américaine. Les chercheurs français vont tenter de bloquer l'activité enzymatique de la protéine AKT, provoquant ainsi l'arrêt de la croissance tumorale et la rémission. Du moins veut-on l'espérer entre Rhône et Saône. Et sur toute la planète. L'essai devrait durer 42 mois. Et, fait particulièrement marquant, symptomatique des innovations thérapeutiques d'aujourd'hui, il est le fruit d'une coopération internationale et tous azimuts. Si la molécule dont on va vérifier l'innocuité appartient à un labo américain, son arrivée au Centre Léon Bérard est le produit d'un accord entre l'Institut national du cancer français et son équivalent aux États-Unis, le NCI. Mais, plus fort encore, le financement (739 000 euros) est lui-même le produit d'un accord entre l'Inca et l'Association pour la recherche sur le cancer (ARC), c'est-à-dire la coopération entre le secteur public et le milieu associatif.
Ce nouvel essai clinique marque donc une double innovation en cours depuis déjà quelques années sur le champ du cancer. La recherche de solutions conjuguées, à travers la mise à disposition de thérapies ciblées et la coopération internationale et public-privé pour accroître l'efficacité contre les cancers.
Fabien Calvo, directeur de la recherche de l'Inca, par ailleurs directeur de l'Institut cancer de l'Inserm (les deux organismes sont partenaires de Futurapolis), explique l'enjeu de cet essai.
Q : Quelle est la portée de cet essai qui s'ouvre à Léon Bérard ?
Fabien  Calvo : Il faut bien voir que cette recherche clinique de très haut niveau vise à long terme un objectif stratégique essentiel : l'accès à l'innovation pour tous les patients en France. Le rôle de l'Institut national du cancer est de faire émerger et de soutenir les innovations thérapeutiques dans le champ du cancer, mais aussi de faire en sorte qu'elles puissent être ensuite accessibles à tous ceux qui en ont besoin. En nous attaquant à AKT, et par la manière dont vont le faire les équipes du Centre Léon Bérard à Lyon, et dans d'autres centres en France, on s'inscrit dans une perspective nouvelle de lutte contre le cancer plus efficace parce que plus ciblée et plus individualisée. Le but est de trouver une réponse - au cas par cas - pour les victimes d'un lymphome diffus à grandes cellules B (4 000 cas par an) qui se trouvent confrontées à une rechute (un peu moins de la moitié). Il s'agit d'identifier des patients qui ont des tumeurs pour lesquelles une anomalie génétique a été caractérisée et de proposer un traitement adapté pour combattre la cause de la maladie. Cette stratégie et ce continuum sont la base de notre démarche de recherche puis d'accès aux soins pour tous.
Calvo : Il faut bien voir que cette recherche clinique de très haut niveau vise à long terme un objectif stratégique essentiel : l'accès à l'innovation pour tous les patients en France. Le rôle de l'Institut national du cancer est de faire émerger et de soutenir les innovations thérapeutiques dans le champ du cancer, mais aussi de faire en sorte qu'elles puissent être ensuite accessibles à tous ceux qui en ont besoin. En nous attaquant à AKT, et par la manière dont vont le faire les équipes du Centre Léon Bérard à Lyon, et dans d'autres centres en France, on s'inscrit dans une perspective nouvelle de lutte contre le cancer plus efficace parce que plus ciblée et plus individualisée. Le but est de trouver une réponse - au cas par cas - pour les victimes d'un lymphome diffus à grandes cellules B (4 000 cas par an) qui se trouvent confrontées à une rechute (un peu moins de la moitié). Il s'agit d'identifier des patients qui ont des tumeurs pour lesquelles une anomalie génétique a été caractérisée et de proposer un traitement adapté pour combattre la cause de la maladie. Cette stratégie et ce continuum sont la base de notre démarche de recherche puis d'accès aux soins pour tous.
Cet essai s'inscrit dans le cadre de l'action de l'Inca, qui a labellisé 16 centres d'essais cliniques de phase précoce, avec la volonté de favoriser l'accès aux molécules innovantes pour les patients en France et de faciliter l'accès aux thérapies ciblées.
Pourquoi ? Ce n'est pas ce qui se faisait ?
Aujourd'hui, un optimisme croissant naît des progrès réalisés dans la compréhension des mécanismes des cancers et du transfert de ces connaissances vers le développement de traitements innovants adaptés. Jusqu'alors, la tendance était de traiter tous les cancers d'un même organe de la même manière. Les cancers du sein, du côlon, du poumon étaient traités selon un protocole identique à chaque type de cancer de façon quasi universelle. La mise en évidence d'altérations moléculaires dans les cellules cancéreuses a permis, en décrivant mieux la maladie, d'identifier de nouvelles cibles thérapeutiques, puis de développer des thérapies "ciblées" contre celles-ci. La caractérisation moléculaire de la tumeur devient ainsi un critère déterminant dans le choix de la stratégie thérapeutique, qui ne repose plus seulement sur le type et le stade de la maladie. Elle permet de prescrire un traitement aux seuls patients susceptibles d'en bénéficier et d'éviter un traitement inutile, parfois toxique et coûteux aux autres patients. En agissant sur des altérations moléculaires spécifiques, les thérapies ciblées constituent ainsi des traitements "sur mesure", qui préfigurent la mise en place à venir d'une médecine personnalisée.
Ce que l'on découvre pour un type de cancer peut avoir des conséquences pour d'autres cancers. La molécule qui s'attaque à AKT fait l'objet de plusieurs autres essais cliniques dans d'autres types de cancer. AKT peut être une excellente cible dans les cancers du sein, du côlon, pour une fraction faible des patients, mais avec des résultats majeurs. On sait que ce qui se cherche au Centre Léon Bérard à Lyon pourra être utilisé contre le lymphome, mais au-delà contre d'autres cancers. Un médicament peut être pertinent sur plusieurs cancers.
Mais cette molécule existe et elle appartient à un laboratoire américain ?
Bien sûr. Et il n'est pas pour nous question de nous substituer à ce laboratoire ou à un quelconque laboratoire, fût-il français. Nous finançons de la recherche académique indépendante des objectifs de développement de l'industriel. Le laboratoire américain Merck n'avait pas envie d'aller dans cette voie ; nous, oui, pour les patients atteints de lymphomes. L'équipe du Dr Ghesquieres à Lyon va identifier 51 patients volontaires, étudier les effets antérieurs de la chimio et de l'immunothérapie et leur proposer une molécule anticancéreuse appropriée. Par la suite, les conclusions de ce travail permettront d'envisager de proposer cette molécule innovante au plus grand nombre. Encore une fois, ce qui vaut pour le lymphome diffus à grandes cellules B peut valoir pour d'autres pathologies, et c'est bien toute l'importance de ce qui va se jouer à Lyon.
Vous voulez dire qu'il y a aussi une innovation dans l'approche elle-même ?
Oui et c'est très symbolique. Les financeurs appartiennent à des mondes différents, l'Institut national du cancer représente la recherche publique, nous sommes financés par les deux ministères de la Recherche et de la Santé et l'Arc est une association caritative. Le laboratoire détenteur de la molécule sur laquelle le Centre Léon Bérard va travailler est américain, et ce sont nos homologues du NCI qui ont permis d'avoir accès à ce nouveau médicament en France. Il y a une coordination des moyens. Là encore, il faut mesurer le chemin parcouru en quelques années. Tout le monde comprend qu'on ne gagnera pas contre le cancer en restant isolé ou en divisant les forces. C'est aussi ça, l'innovation. La recherche clinique précoce est un enjeu décisif, chacun en a pris la mesure. Si l'on veut faire un saut significatif, il faut décloisonner et rassembler ce qui est épars. Il n'y a pas d'autres choix et c'est ce qui se produit de nouveau avec le financement de cet essai clinique sur le lymphome.
On espère tous que, dans moins de deux ans, on en tirera des conclusions favorables pour les malades. On est confiants et on avance.
En direct des laboratoires de l'institut de Chimie
SOURCE : cliquer ICI
Vers une approche thérapeutique micro-ciblée du cancer
Les kinases sont des protéines fondamentales dans le contrôle des fonctions du vivant. De nombreux processus de cancérisation trouvent leur origine dans le dysfonctionnement de certaines de ces kinases. L’une d’elles, la protéine kinase B (pKB), est à la base de la survie cellulaire et de la croissance tissulaire. Comment éviter l’activation ou la désactivation intempestives de ces processus vitaux ? Une étroite collaboration entre des spécialistes de modélisation moléculaire du laboratoire Chimie et Biologie des membranes et des nanoobjets (Université Bordeaux 1/CNRS/ENITA) et des biologistes britanniques a permis de disséquer toutes les étapes du processus d’activation de pKB, ouvrant la voie à la recherche de thérapeutiques micro-ciblées contre certaines formes de cancer.
Les kinases sont les maîtres d'œuvre de la régulation de la cellule et toute erreur dans leur fonctionnement peut avoir des répercussions pathologiques graves, comme le cancer. Elles sont très nombreuses chez l’homme où l’on en dénombre 518. Leur fonctionnement est complexe car elles sont au cœur d’un réseau d’interactions avec d’autres protéines, en particulier avec d’autres kinases. Dans de nombreux cas on observe des phénomènes de cascade : une kinase est activée par une autre kinase qui elle-même…, etc. Ceci laisse imaginer l'ampleur des dysfonctionnements possibles qui traduisent toute la complexité des pathologies que recouvre le simple vocable "cancer".
Toutes les kinases n'ont heureusement pas la même importance. Cependant certaines d'entre elles sont cruciales pour des phénomènes fondamentaux de la vie comme la reproduction et la multiplication cellulaire. Dans ces cas là, la nature a mis en place toute une stratégie de sécurité pour éviter des activations ou des désactivations intempestives. L’une de ces kinases clé, la protéine kinase B (pKB ou AKT-1) est à la base de la survie cellulaire et de la croissance tissulaire. On commence seulement à découvrir son implication très importante dans différents processus de cancérisation et dans la résistance à la chimiothérapie.
Une étroite collaboration entre Michel Laguerre, du groupe de modélisation moléculaire du laboratoire « Chimie et Biologie des Membranes et des Nanoobjets » (CBMN, Bordeaux-Pessac) et l'équipe de Biophysique Cellulaire dirigée par Banafshé Larijani de l’Institut du Cancer (CRUK) à Londres, a permis d’identifier et de réassembler de façon précise toutes les étapes de son cycle d'activité. Cette approche a mis en jeu d’une part la biologie moléculaire, l’imagerie cellulaire et la biologie structurale pour identifier au niveau moléculaire les différents morceaux du puzzle ; d’autre part, la modélisation moléculaire a joué un rôle clé en proposant la structure complète du complexe par reconnaissance des surfaces de contact (hydrophobie, électrostatique). Une série d'allers-retours entre les propositions de la modélisation moléculaire et les expériences multidisciplinaires de la biologie a conduit à la validation de l'assemblage complet ainsi que des différentes étapes du processus d'activation.
Dans le cas particulier de pkB, quatre niveaux de sécurité on été identifiés. Ces verrous doivent être franchis dans un ordre précis pour arriver à l'activation définitive de la kinase. Si un seul niveau n'est pas validé, la kinase ne s'active pas. L’ordre inverse doit être également parcouru pour l'inactivation de la kinase. Là encore, il s'agit d'éviter une inactivation intempestive de la kinase. Il doit y avoir en outre, au cours de la phase d'activation, la présence de deux kinases partenaires et au cours de la phase d'inactivation, celle de deux phosphatases partenaires.
Au total, entre les phases d'activation et d'inactivation de pKB, on compte huit niveaux de dérégulation possibles sur lesquels la pharmacopée est susceptible d'intervenir de façon spécifique avec des molécules appropriées (médicaments). Les traitements contre le cancer s’orientent actuellement de plus en plus vers une thérapeutique ciblée. Dans ce cas précis, les résultats acquis ouvrent la voie à une thérapeutique "micro-ciblée" susceptible d’agir sur l'une quelconque de ces huit étapes en fonction de la pathologie en cause.
© Michel Laguerre
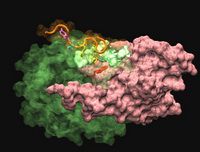
Structure finale de la kinase pkB, le complexe est ouvert comme les pages d'un livre. Le domaine de régulation (PH) est à gauche et le domaine kinase est à droite. Quand le domaine PH se referme sur le domaine kinase grâce à la complémentarité des zones hydrophobes et chargées, il masque complètement l'accès au domaine catalytique fixant l'ATP.
© Michel Laguerre
Structure 3-D de la kinase pkB dans sa conformation inactive. Le domaine de régulation (PH) en surface rose est enfoncé dans le domaine kinase en surface verte transparente. L'acide aminé en rouge appartenant au domaine PH est pris en tenaille par les deux acides aminés jaunes (phényl-alanines) provenant de la partie terminale (en ruban orange), cadenassant ainsi la protéine dans une conformation totalement inactivable. C'est la phosphorylation de la sérine en bleu qui va constituer la première étape du processus d'activation.
____________________________________________________________
Thérapie cellulaire
Nouvel espoir pour les cancers sanguins
BUM 23 juillet 2010
Dix-sept personnes en rechute d'une leucémie ou d'un lympome et n'ayant aucune option médicale ont participé à une étude française pour trouver le moyen de traiter les cancers sanguins.
Grâce à une nouvelle thérapie cellulaire, le tiers des personnes a vu sa rémission être prolongée de deux ans en moyenne.
Cette nouvelle technique utilise le système immunitaire pour s'attaquer au cancer. On injecte au patient des lymphocytes (globules blancs) manipulés afin de les rendre anticancéreux.
Généralement, la leucémie et le lymphome peuvent être traité par une greffe de moelle osseuse. On remplace la moelle du patient par une moelle d'un donneur sain, mais cette technique ne donne pas toujours les résultats escomptés.
La nouvelle thérapie porrait s'avérer une option intéressante, selon le Science Translational Medecine.
Naturellement, des tests devront être effectués sur un échantillon plus large de patients afin de confirmer les résultats.
(23/07/2010)
Une équipe de chercheurs et de médecins français (AP-HP, CNRS, INSERM, Universités Pierre et Marie Curie, Paris-Est Créteil Val de Marne) publie les résultats* très encourageants d'une
nouvelle thérapie cellulaire dans le traitement de patients atteints d'un lymphome ou d'une leucémie en échec thérapeutique.
L'allogreffe (greffe avec donneur) de cellules souches hématopoïétiques est le traitement de choix de plusieurs affections malignes hématologiques. Son effet anti-cancéreux repose sur le remplacement de la moelle osseuse du malade par celle du donneur mais aussi par le fait que les lymphocytes greffés peuvent exercer un effet anti-tumoral (réaction du greffon contre l'hôte). Ce traitement ne suffit pas toutefois à contrôler la maladie dans tous les cas.
La nouvelle thérapie cellulaire s'adresse précisément aux patients en échec thérapeutique après
allogreffe de cellules souches. La technique consiste à éliminer du greffon les lymphocytes T-régulateurs, qui inhibent l'activité anticancéreuse des autres lymphocytes.
L'essai a porté sur dix-sept patients en rechute. Ils ont reçu une injection d'un greffon ainsi modifié. Deux patients ont développé une réaction du greffon contre l'hôte et une rémission à long terme. Quatre des quinze patients qui n'avaient pas répondu à ce premier traitement ont reçu une nouvelle
injection, associée à une chimiothérapie destinée à combattre leurs propres lymphocytes T-régulateurs. Tous ont été répondeurs et ont bénéficié d'une rémission partielle ou complète durable.
Dans toute la cohorte, l'induction d'une réaction du greffon contre l'hôte grâce à la déplétion en lymphocytes T-régulateurs a été associée à une amélioration de la survie.
Pour les auteurs, ces résultats suggèrent que l'injection d'un greffon allogénique appauvri en lymphocytes T-régulateurs est une approche sure et faisable, qui induit une réaction du
greffon contre l'hôte chez les patients résistants à l'alloréactivité. Chez les patients qui ne répondent pas à cette approche, une déplétion en lymphocytes induite par une chimiothérapie agit en synergie avec l'injection d'un greffon allogénique ne contenant pas de lymphocytes T-régulateurs.
*CD4+CD25+ Regulatory T Cell Depletion Improves the Graft-Versus-Tumor Effect
of Donor Lymphocytes After Allogeneic Hematopoietic Stem Cell Transplantation.
Sébastien Maury et al. Sci Transl Med 21 July 2010. Vol 2, Issue 41, p 41ra52
doi :10.1126/scitranslmed.3001302
____________________________________________________________________________
Pr. Gilles Salles
Le lymphome non hodgkinien est un cancer que l'on soigne bien mais qu'on ne peut pas guérir grâce aux traitements actuels. L'arrivée de nouveaux anticorps monoclonaux associés à la chimiothérapie a changé la prise en charge et continue aujourd'hui de l'améliorer. Le point avec le Pr. Gilles Salles, hématologue à Lyon.
http://videos.doctissimo.fr/sante/cancers/Traitement-des-lymphomes-non-hodgkiniens.html
___________________________________________________
Traitement d’entretien
Lymphome folliculaire, le traitement d’entretien fait ses preuves
Destination Santé le 22 Juin 2010
« Dans le lymphome folliculaire, la moitié des patients rechutent, que faire ? » La question posée par le Pr Gilles Salles, hématologue aux Hospices civils de Lyon, n’est aujourd’hui plus sans réponse. Au congrès de l’American Society of Clinical Oncology qui se tient à
Chicago, il a fait part des résultats positifs obtenus dans la prévention des rechutes de ces lymphomes. L’étude qu’il a présentée en session plénière, est la plus importante jamais réalisée dans le lymphome folliculaire. Dans 25 pays, 225 services ont été mobilisés pour au final recruter 1 028 patients dont une majorité en France.
L’objectif de ce travail était d’évaluer l’efficacité d’un traitement d’entretien dans la prévention des rechutes. « Il s’agit, après le traitement initial par
une association de rituximab – un traitement de la classe des anticorps monoclonaux, n.d.l.r. – et d’une chimiothérapie, de poursuivre la prise en charge pour mieux contrôler la maladie et prévenir les rechutes »,
explique-t-il. Le protocole retenu pour cette étude reposait sur l’administration de rituximab en milieu hospitalier, à raison d’une fois tous les 2 mois.
« Chez les patients qui ont continué à être traités (de la sorte), le risque de progression du cancer a été divisé par deux par rapport aux malades qui n’ont pas reçu de traitement d’entretien », souligne le Pr Gilles Salles. « Ils ont vu
leur nombre de rechutes diminuer, (et cette forme de) traitement d’entretien va probablement devenir un nouveau traitement standard chez les patients souffrant de lymphome folliculaire ». Une extension de l’autorisation de mise sur le marché a d’ailleurs déjà été déposée auprès de l’Agence européenne du Médicament (EMEA) et de la Food and Drug Administration (FDA) américaine.
Les lymphomes folliculaires sont relativement fréquents : ils représentent
de 20% à 30% des lymphomes non hodgkiniens. Ainsi chaque année, entre 2 000 et 3 000 cas sont-ils diagnostiqués en France. Ils touchent généralement des adultes d’âge moyen ou plus âgés. Pour davantage d’informations, consultez le site de l’Association France Lymphome Espoir :
____________________________________________________
Radioimmunothérapie
Place de la radioimmunothérapie dans la stratégie thérapeutique des lymphomes folliculaires Professeur Martine Raphael et Docteur Gérard Tertian (Service d’Hématologie Biologique, Hôpital Bicêtre, Le Kremlin-Bicêtre)
Les traitements efficaces dans les lymphomes folliculaires (LF) sont très divers : en dehors de l’abstention thérapeutique, prônée dans certaines formes de faible masse tumorale, citons la radiothérapie, la mono ou la polychimiothérapie associée ou non à l'interféron, la fludarabine, l’autogreffe de cellules souches hématopoïétiques, l’allogreffe avec
conditionnement standard ou atténué, les anticorps monoclonaux, la
vaccination, les anti-sens bcl2, les inhibiteurs du protéasome. La stratégie thérapeutique des LF doit être adaptée au risque, d'où l'intérêt du score pronostique international des LF ou FLIPI (Solal-Celigny P, Blood, 2004) qui permet, en fonction du nombre de facteurs de mauvais pronostic présents au diagnostic (âge > 60 ans, hémoglobine < 12 g/dL, LDH élevées, stade III-IV et > 4 sites ganglionnaires envahis), d'individualiser trois
groupes de patients : risque faible (0-1 facteur, 71% de survie à 10 ans), risque intermédiaire (2 facteurs, 51% de survie à 10 ans), et risque élevé (> 3 facteurs, 36% de survie à 10 ans). Chez les patients à risque faible
(index FLIPI 0 ou 1), l'attitude peut être l'abstention thérapeutique avec surveillance, un traitement par anti-CD20 ou éventuellement une autre forme d'immunothérapie. Chez ceux de risque intermédiaire (index FLIPI 2), une mono ou polychimiothérapie ou une immunothérapie peuvent être proposées. Pour les patients de risque élevé, le traitement de référence reste la polychimiothérapie associée au rituximab (R-CHOP ou R-CHVP +
interféron), la place de la fludarabine associée au cyclophosphamide ou à la mitoxantrone et celle de la greffe de cellules souches hématopoïétiques restant à déterminer. Le bénéfice d'un traitement d'entretien par un anticorps monoclonal anti-CD20 sur la survie sans événement a, par ailleurs, été démontré par plusieurs études, notamment celle de Van Oers (ASH 2004) qui a retrouvé, chez 369 patients traités pour un LF en rechute par CHOP ou R-CHOP, un net avantage de survie sans événement à 3 ans (67,7% versus 31,2%) chez les patients recevant un traitement d'entretien par rituximab.
La radioimmunothérapie (RIT) consiste à administrer un anticorps monoclonal couplé à une substance radioactive. Elle offre deux
avantages par rapport à l'anticorps monoclonal "froid" pour le traitement des LNH : d'une part, les cellules lymphomateuses sont radiosensibles, d'autre part la radioactivité va diffuser localement autour des cellules fixant l'anti-CD20 et toucher les cellules voisines, d'où l'intérêt notamment en cas de masses tumorales volumineuses ou mal vascularisées.
Deux anticorps existent :
• L'90Y ibritumomab (Zevalin®, seul commercialisé, est un anti-CD20 couplé de façon stable par l'intermédiaire du Tiuxetan à l'yttrium 90 (90Y),
émetteur β pur à courte distance d'émission permettant de délivrer 90% de l'énergie sur 5 mm.
• Le 131I tositumomab (Bexxar®), non disponible en Europe, est un anti-CD20 couplé à l'iode 131 (131I) dont la demi-vie est plus longue et qui nécessite, contrairement au Zevalin®, une hospitalisation en secteur protégé.
D'autres anticorps couplés sont en cours de développement : anti-CD22
couplés l'90Y ou à l'131I, anti-HLA-DR couplé à l'90Y, à l'131I ou au 67Cu, anti-CD19 couplé à l'90Y.
La RIT offre de nouvelles perspectives de traitement des LF :
• Chez les patients en rechute ou réfractaires:
- Un essai multicentrique de phase I-II (Witzig TE, J Clin Oncol, 1999) a montré l'efficacité et la bonne tolérance de la RIT chez 51 patients ayant un LNH B CD20+ en rechute ou réfractaire (34 de bas grade, 14 de grade intermédiaire et 3 lymphomes du manteau). Les taux de RO, de RC et de RP étaient meilleurs pour les formes histologiques de faible grade que pour les formes de grade intermédiaire (82% de RO versus 43%). A noter qu'aucune réponse même partielle n'a été obtenue chez les trois patients traités pour un lymphome du manteau.
- Une étude randomisée comparant Zevalin® au rituximab seul dans des
LF en rechute ou réfractaires a montré un avantage du bras Zevalin®
en termes de taux de RO (80% versus 56%), de taux de RC (30% versus
16%) et de délai avant retraitement (Witzig TE, J Clin Oncol, 2002).
- Dans une étude de phase III, Zevalin® a permis d'obtenir, chez des patients réfractaires au rituximab, 74% de RO et 15% de RC (Witzig TE, J Clin Oncol, 2002).
- Dans une série de 40 patients ayant des lymphomes B indolents ou en transformation et progressant après rituximab, la RIT par Bexxar® permet d'obtenir des taux de RO et de RC de 65% et 38% avec un délai médian de progression de 10,4 mois (Horning SJ, J Clin Oncol, 2005).
• En première ligne de traitement :
L'efficacité de la RIT par le Bexxar® en traitement de première ligne a été
rapportée par Kaminski MS (N Engl J Med, 2005) sur une série de 76 patients ayant un LF de stade III-IV : les taux de RO et de RC sont de 95% et 75%, la survie sans progression à 5 ans de 59%, et une rémission moléculaire est obtenue chez 32 sur 36 patients informatifs.
• En traitement de consolidation :
- Dans la série de Press OW (Blood, 2003) 90 patients ont reçu 6 cures de CHOP suivies 4 à 8 semaines après d'une RIT par Bexxar®. Les taux de RO et de RC sont de 90% et 67%. De plus, 57% des patients qui n’étaient pas en RC après la chimiothérapie ont eu secondairement un bénéfice de la
RIT.
- Dans celle de Leonard JP (J Clin Oncol, 2005), les patients ont reçu d'abord 3 cures de fludarabine, permettant d'obtenir 89% de réponses dont 9% de RC. La RIT par Bexxar® 6 à 8 semaines après la chimiothérapie fait passer les taux de RO et de RC à 100% et 86%. La survie médiane sans progression est de 48 mois.
- Enfin, une étude de phase III perspective, multicentrique et randomisée est en cours dont le but est de comparer, dans des LNH folliculaires stade III-IV en RC ou en RP après une chimiothérapie de première ligne, l'abstention thérapeutique et un traitement de consolidation par Zevalin®.
En résumé, on s'achemine dans les lymphomes folliculaires vers un traitement à la carte qui devra tenir compte des facteurs pronostiques initiaux, du traitement et surtout de la réponse clinique et moléculaire au traitement. De nouveaux facteurs pronostiques tels que l'expression génomique et l'expression protéique sont en cours d'évaluation. La RIT est un traitement efficace dont la place dans le schéma thérapeutique, en première ligne ou après réduction tumorale, devra être précisée par les
études en cours et à venir.
__________________________________________________
Lymphomes et leucémies
Le lymphome est une tumeur principalement solide, alors que la leucémie touche la moelle et le sang. Mais il existe de nombreuses formes frontières, des « lymphomes leucémisés » envahissant le sang et la moelle.
L’altération d’un même type de cellule (par exemple une cellule B mature) peut donner un lymphome (par exemple le lymphome de Burkitt) ou une leucémie (de type LAL-B, B-CLL,..).
De plus, il semble toujours y avoir une phase de lymphome dans la leucémie.
En gros, certaines leucémies sont biologiquement plus proches de
certains lymphomes que les lymphomes entre eux dénotant toute la complexité d'une telle classification binaire.
Le diagnostic de ces familles de maladies s’appuie donc sur de
nombreux critères.
____________________________________________________
l’ Antimatière
Chez certains patients, la chimiothérapie peut se révéler presque aussi terrible que le cancer qu’elle est censée soigner. Des chercheurs de l’UCLA's Crump Institute for Molecular Imaging explorent le moyen de mieux cibler ce traitement selon les individus. La clé repose sur l’antimatière.
La chimiothérapie fait partie de l’arsenal des traitements dont dispose la médecine pour lutter contre le cancer.
Malheureusement, en raison même de leur pouvoir actif, les
substances mises en jeu ne sont pas sans effet néfaste sur
l’organisme et chez certaines personnes, le remède peut se révéler
pire que les effets de la tumeur.
C’est particulièrement le cas lorsque les cellules cancéreuses
mutent et que le traitement devient inadapté. Avant de s’en rendre compte, il peut s’écouler un temps précieux, des mois gaspillés en pure perte et une accumulation inutile d'effets
secondaires indésirables.
Pour essayer de surmonter cet obstacle, le docteur Caius Radu a entrepris de marquer avec des isotopes radioactifs une molécule ressemblant à celle fréquemment utilisée en chimiothérapie, la gemcitabine. En se désintégrant, le noyau
radioactif de l’isotope émet un positron, la fameuse particule d’antimatière correspondant à l’électron.
Traçage de l'action de la molécule active
Or, selon le type de cellule cancéreuse et la capacité de
répondre à un traitement, les molécules de la chimiothérapie
pénètrent ou non dans la tumeur. Lorsqu’elles n’y pénètrent
pas le traitement est évidemment inopérant. Voilà pourquoi l’idée
de marquer une substance active avec un isotope produisant des
positrons devient intéressante. En effet, un PET scan donnera une image de la répartition de la substance active dans un organisme. On pourra de cette manière vérifier si le traitement pénètre dans les cellules cancéreuses et si la tumeur continue à se développer. On obtiendra ainsi un diagnostic rapide de l’effet du traitement.
Les chercheurs ont réalisé des tests sur des souris ayant développé des leucémies et des lymphomes et ils ont obtenus des résultats plutôt satisfaisants, exposés dans les Pnas (Proceedings of the National Academy of Sciences). Plus la concentration en substance ressemblant à la gemcitabine, mais inactive donc sans effets secondaires nocifs, est importante, plus les cellules tumorales apparaissent brillantes sous l’œil de la caméra à positrons. La méthode est avantageuse car elle est complètement non invasive.
Toutefois, elle n’a jusqu’ici fait ses preuves que chez l’animal. Reste donc à voir ce qu’elle donnera sur l’homme…
Des tests sur des volontaires sont en cours et si l’innocuité de
la méthode se vérifie
__________________________________________________
Bexxar
Bexxar est un nouveau traitement plus performant des lymphomes
Selon l'article du Dr Kaminski, oncologiste au Centre Médical de l'université du Michigan à Ann
Arbor, et ses collègues, publié en février 2005 dans le New England Journal of Medicine, des injections d'un anti-corps radio-actif ont permis la guérison pendant au moins cinq ans d'un grand nombre de malades atteints de lymphome nodulaire. Ce traitement est beaucoup plus rapide que les précédants et n'entraîne que peu d'effets secondaires
Ce nouveau traitement des lymphomes a permis d'obtenir une diminution des tumeurs chez 95% des malades.
Un groupe de 76 malades a reçu des injections de Bexxar ( Tositumomab et Iode 131) pendant une semaine: 95% ont enregistré une réponse partielle, 75% ont vu leur tumeur disparaître complètement. Le taux d'absence de maladie à 5 ans fut de 59% et de 77% chez les personnes ayant connu une rémission complète. Le taux de survie à 5 ans fut de 89%.
Les effets secondaires furent modérés et réversibles. Il n'y eut entre autres pas de pertes de cheveux et seulement quelques minimes nausées.
L'éditorial du Dr. Joseph M. Connors, de l'université de Colombie Britannique à Vancouver, note
cependant que la supériorité de ce nouveau traitement doit cependant être vérifiée par d'autres essais soigneux.
New England Journal of Medicine, 3Février 2005
__________________________________________________
Un composé qui tue les cellules du lymphome
Découverte d'un composé qui tue les cellules du lymphome
http://www.bulletins-electroniques.com/actualites/63082.htm
Une équipe internationale de recherche, menée par l'Ontario Cancer Institute (OCI,) a découvert un composé qui tue spécifiquement les cellules du lymphome. Cette découverte qui permettra d'accélérer le développement de médicaments ciblés pour lutter contre la forme la plus commune de lymphome non hodgkinien.
Les résultats de la recherche, publiés le 13 avril 2010 dans le journal "Cancer Cell", montrent qu'un composé chimique permet de bloquer la protéine BCL6. Cette protéine est connue pour être responsable environ de la moitié de tous les lymphomes cancéreux non hodgkiniens, le cinquième type de cancer le plus courant au Canada.
La protéine BCL6 est également l'oncogène le plus fréquemment
impliqué dans les formes diffuses de lymphomes à grandes cellules B (DLBCL).
Des travaux antérieurs ont montré que la protéine BCL6 est nécessaire pour la survie des cellules du lymphome et que
le blocage du gène tue les cellules DLBCL. Cependant, bien que la
protéine BCL6 soit une cible thérapeutique très intéressante,
elle était considérée comme difficilement blocable par de petites
molécules. En effet, comme de nombreux oncogènes, la BCL6 est un facteur de transcription. Les facteurs de transcription exercent
leurs actions par le biais d'interactions importantes avec d'autres
protéines. Or les petites molécules inhibitrices sont habituellement considérées comme non susceptibles de perturber efficacement ces interactions protéine-protéine. Cependant, cette récente étude prouve le contraire.
Dans cette étude, les scientifiques ont commencé leur quête en utilisant la cristallographie 3D afin de déterminer quel était le meilleur point d'attaque susceptible de perturber l'activité du BCL6. Par la suite, ils ont utilisé la conception de médicaments assistée par ordinateur (combinée avec des tests fonctionnels) pour filtrer plus d'un million de composés potentiels et réduire à 100, puis à 10 le nombre de molécules médicamenteuses pouvant interagir avec la protéine BCL6. Les chercheurs se sont intéressés à un sillon exposé dans le domaine BTB du BCL6, puisqu'il s'agit du site de liaison de cofacteurs nécessaires à la protéine pour mener à bien ses fonctions cancérigènes.
Au final, l'un des composés, appelé 79-6, lié spécifiquement au sillon BTB a été identifié et a efficacement tué des lignées cellulaires DLBCL positives au BCL6. Ce composé a sensiblement réduit les tumeurs associées au BCL6 chez des souris qui avaient reçu des greffes de cellules de lymphome humain. De plus, le 79-6 a éliminé spécifiquement les cellules humaines DLBCL primaires, laissant ainsi entrevoir un faible taux de toxicité pour les cellules saines.
______________________________________________________________________
La radiothérapie liquide
Un nouveau traitement du traitement du lymphome non hodgkinien
Les lymphomes sont des proliférations cellulaires malignes (ou cancer) du tissu lymphoïde. Un nouveau traitement pourrait révolutionner le traitement du lymphome non hodgkinien : il s'agit de la radiothérapie liquide. Il peut être administré en consultation externe pendant une semaine, contrairement à six à huit mois pour la chimiothérapie classique. Il n'est pas nécessaire d'hospitaliser le patient durant le traitement ce qui lui permet de continuer d'exercer ses activités courantes sans que cela dérange son style de vie. Ce traitement, qui est maintenant disponible en
primeur après avoir été approuvé par Santé Canada, a déjà été utilisé pour 15 patients du Centre Universitaire de Santé de McGill (CUSM). Le Dr Ahmed Galal, directeur du Programme de transplantation des cellules souches du CUSM déclare que 80% des patients qui résistaient à la chimiothérapie et à l'immunothérapie ont bien réagi au traitement après avoir reçu une seule dose, et qu'il y a eu rémission complète dans 30% dans cas.
En outre, la nouvelle thérapie n'entraîne pas de perte de cheveux et de nausées comme c'est le cas avec des traitements classiques comme la
chimiothérapie.
Cette information est un extrait du BE Canada
numéro 283 du 13/09/2005 rédigé par l'Ambassade de France au
Canada. Les Bulletins Electroniques (BE) sont un service ADIT et sont
accessibles gratuitement sur :
http://www.bulletins-electroniques.com/
Précision :
Ces articles médicaux représentent le résultat de mes recherches d'informations concernant les nouveaux traitements du lymphome.
Pour obtenir plus de précisions, suivant votre région ou votre pays, adressez-vous à votre oncologue, ou hématologue, à votre équipe médicale.
Vous pouvez prendre un second avis auprès d'un autre spécialiste, c'est conseillé. Il est important d'être en confiance avec le médecin qui vous suit, de participer à votre guérison.
Il existe également des sites "sérieux" pour répondre à vos questions.
Ils comportent souvent un "forum" de discussion qui permet d'échanger avec d'autres patients.
- France Lymphome Espoir, "FLE", est l'un d'eux. Cette association organise également des réunions dans les hôpitaux avec des spécialistes, des patients et leurs familles.
- Le "GELA", Groupe d'Étude des Lymphomes de l'Adulte en est un autre.
(vous trouverez les liens en page d'accueil).
Pour ma part, placé en abstention thérapeutique, je n'ai suivi aucun traitement depuis 4 ans, mais une surveillance régulière.
Tous les 6 mois j'ai rendez-vous avec mon hématologue. Dans un premier temps je passais un scanner thoraco-abdomino-pelvien et un examen de sang avant chaque RDV. Désormais, en vue de mes résultats, les séances de scanner sont plus espacée, une par an.
Je ne peux donc pas en l'instant porter concrètement témoignage concernant un traitement.
A découvrir aussi
Inscrivez-vous au blog
Soyez prévenu par email des prochaines mises à jour
Rejoignez les 8 autres membres